Verschillende typen corrosie
Begin bij de bron van het probleem
Corrosie is de fysieke degradatie van een materiaal als gevolg van interacties met de omgeving. Corrosie treedt op wanneer een metaalatoom wordt geoxideerd door een vloeistof, wat leidt tot materiaalverlies in het metaaloppervlak. Dit verlies leidt tot een afname van de wanddikte van een onderdeel en verhoogt de kans op mechanische defecten.

Algemene (uniforme) corrosie
Algemene of uniforme corrosie is het gemakkelijkst te herkennen. Leer het te herkennen.

Plaatselijke putcorrosie in chloridehoudende media
Leer hoe putjes ontstaan op materiaaloppervlakken.

Plaatselijke spleetcorrosie in chloorhoudende media
Zie hoe corrosie zich kan vormen in de spleten en krappe ruimtes van een vloeistofsysteem.

Spanningscorrosie in chloridehoudende media
Leer meer over hoe spanningscorrosie kan leiden tot materiaalbreuk.

Scheuren door zuurgas of sulfidespanning bij hoge partiële waterstofsulfide druk (H2S)
Zure gasomgevingen kunnen leiden tot sulfide spanningscorrosie. Ontdek hoe het ontstaat.

Waterstofbrosheid
Waterstofatomen kunnen diffunderen in metalen, waardoor ze broos worden. Het kiezen van resistente materialen kan helpen.

Interkristallijne corrosie
Leer meer over hoe interkristallijne corrosie materialen beïnvloedt.

Galvanische corrosie in aanwezigheid van een elektrolyt
Om galvanische corrosie te voorkomen is het herkennen van de oorzaak belangrijk

Algemene (uniforme) corrosie
Het meest bekende type corrosie is ook het eenvoudigst te herkennen en te voorspellen. Het is ongebruikelijk - maar niet ongehoord - dat algemene corrosie tot erge defecten leidt. Algemene corrosie treedt relatief gelijkmatig op over een metaaloppervlak. De geleidelijke afname van de wanddikte van een onderdeel moet in aanmerking worden genomen bij het berekenen van drukwaarden.
Hoe het ontstaat
In een mariene of andere corrosieve omgeving begint het oppervlak van koolstof- of laag gelegeerd staal af te breken, waardoor een ijzeroxideschaal kan ontstaan die na verloop van tijd dikker wordt totdat hij afbladdert en er nieuwe schalen ontstaan.
Kan worden gemeten door
- Hoe snel het materiaal terugloopt op jaarbasis. Bijvoorbeeld, onbeschermd koolstofstaal kan in een mariene omgeving elk jaar 1 mm afnemen.
- Het gewichtsverlies dat een legering ondergaat wanneer deze in contact komt met corrosieve vloeistoffen. Meestal gemeten in milligram per vierkante centimeter blootgesteld materiaal per dag.
Mogelijke oplossingen

Plaatselijke putcorrosie in chloridehoudende media
Putcorrosie veroorzaakt kleine holtes of putjes op het oppervlak van een materiaal. Hoewel deze putjes ontdekt kunnen worden door een grondige visuele inspectie, kunnen ze diep genoeg worden om tubes te doorboren. Putcorrosie wordt vaker waargenomen in omgevingen met veel chloride en bij hoge temperaturen.
Hoe het ontstaat
Wanneer de beschermende oxidelaag (of passieve oxidelaag) op het metaaloppervlak afbreekt, wordt het metaal gevoelig voor verlies van elektronen. Hierdoor lost ijzer in het metaal op in een oplossing op de meer anodische bodem van de put. Het diffundeert naar de bovenkant en oxideert tot ijzeroxide, of roest. De concentratie ijzerchlorideoplossing in een put kan toenemen en zuurder worden naarmate de put dieper wordt. Deze veranderingen resulteren in versnelde groei van de put, perforatie van tubewanden en lekken.
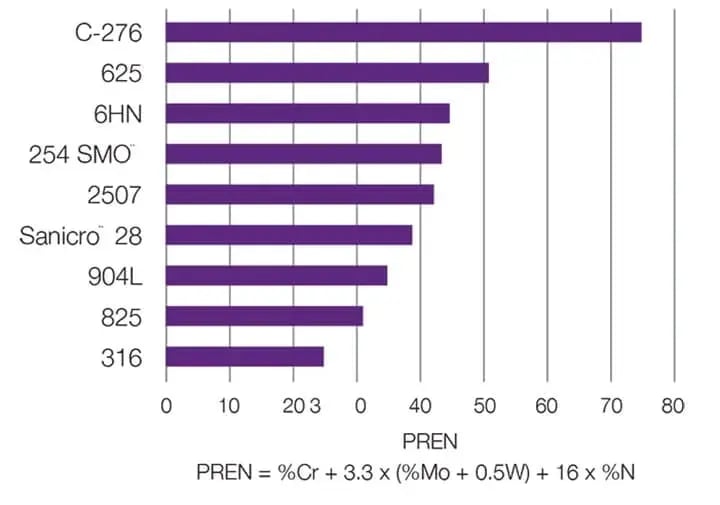
Hogere PREN-waarden (Pitting Resistance Equivalence Number) duiden op een grotere weerstand tegen putcorrosie. Putcorrosie kan het best worden voorkomen door de juiste keuze van de legering. Verschillende metalen en legeringen kunnen worden vergeleken met behulp van hun PREN-getal, dat wordt berekend op basis van de chemische samenstelling van het materiaal. PREN neemt toe met hogere gehaltes aan chroom, molybdeen en stikstof.
Mogelijke oplossingen

Plaatselijke spleetcorrosie in chloorhoudende media
In een typisch gas- en vloeistofsysteem komen spleten voor tussen leidingen en tubesteunen of -klemmen. Ook tussen aangrenzende leidingen en onder vuil en afzettingen die zich op oppervlakken kunnen hebben opgehoopt. Spleten zijn vrijwel onmogelijk te vermijden in tube-installaties en nauwe spleten vormen het grootste gevaar voor corrosie.
Hoe het ontstaat
Net als putcorrosie begint spleetcorrosie met de afbraak van de passieve oxidelaag die het metaal beschermt. Deze afbraak leidt tot de vorming van kleine putjes. De putjes worden groter en dieper tot ze de hele spleet bedekken. Op sommige plaatsen kunnen tubes geperforeerd worden. Spleetcorrosie treedt op bij veel lagere temperaturen dan putcorrosie.
Materiaal is van belang
Wanneer zeewater in een spleet diffundeert, lossen sommige Fe++ ionen op en kunnen ze niet snel uit een nauwe spleet diffunderen. In zout water worden negatief geladen chloride-ionen (Cl-) aangetrokken door deze positief geladen Fe++ ionen en beginnen in de spleet te diffunderen. Naarmate de chlorideconcentratie toeneemt, wordt de spleetoplossing corrosiever, waardoor meer ijzer oplost, wat weer meer chloride-ionen aantrekt die in de spleet diffunderen. Uiteindelijk verandert de spleetoplossing in een zure oplossing met een hoge chlorideconcentratie, die zeer corrosief is.
Mogelijke oplossingen

Spanningscorrosie in chloridehoudende media
Spanningscorrosie cracking (SCC) is gevaarlijk omdat het een onderdeel kan vernietigen bij spanningsniveaus onder de vloeigrens van een legering. In de aanwezigheid van chloride-ionen is austenitisch roestvast staal gevoelig voor SCC. De ionen interageren met het materiaal aan het uiteinde van een scheur waar de trekspanningen het hoogst zijn. Hierdoor kan de scheur eenvoudiger groeien. Tijdens het proces kan SCC moeilijk te detecteren zijn en het uiteindelijke falen kan plotseling optreden.
Hoe het ontstaat
Om SCC te laten ontstaan, moet tegelijkertijd aan drie voorwaarden worden voldaan:
- Het metaal moet vatbaar zijn voor SCC
- De omgevingsomstandigheden (vloeistof of temperatuur) moeten bevorderlijk zijn voor SCC
- De trekspanning (uitgeoefend + restspanning) moet boven het kritieke niveau liggen

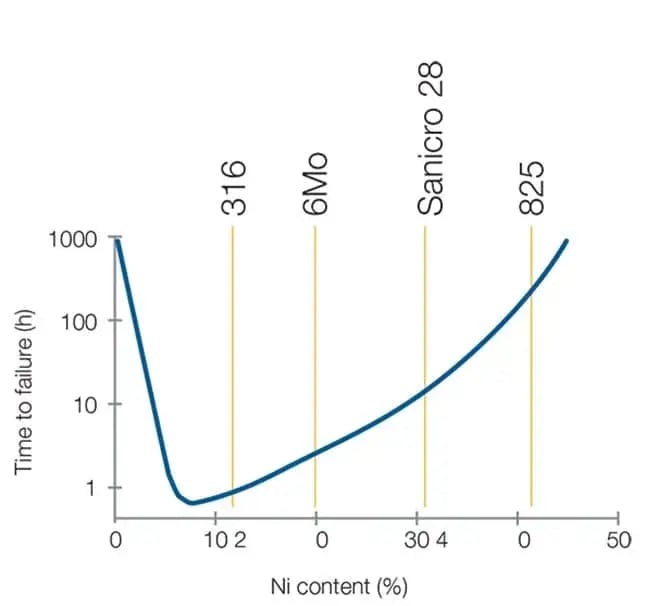
Een hoger nikkelgehalte toont een hogere weerstand tegen door chloride veroorzaakte SCC
Mogelijke oplossingen

Scheuren door zuurgas of sulfidespanning bij hoge partiële waterstofsulfide druk (H2S)
Scheuren door zuur gas, ook wel bekend als sulfide stress cracking (SSC), is de aantasting van metaal door contact met waterstofsulfide (H2S) en vocht. H2S wordt zeer corrosief in de aanwezigheid van water. Deze toestand kan leiden tot verbrossing van het materiaal, wat resulteert in scheuren door de combinatie van trekspanning en corrosie.
Hoe het ontstaat
Het risico op SSC neemt toe wanneer de volgende factoren toenemen:
- Het metaal moet gevoelig zijn voor SSC
- De omgeving moet voldoende zuur zijn (hoog in H2S)
- De trekspanning (uitgeoefend + restspanning) moet boven een kritisch niveau liggen
Verhoogd risico op SSC treedt op wanneer grotere hoeveelheden van het volgende voorkomen, vergeleken met materialen die minder waarschijnlijk SSC zullen ondervinden:
- Materiaalhardheid/ treksterkte
- Waterstofionenconcentratie (lagere pH-waarde)
- H2S partiële druk
- Totale trekspanning (uitgeoefend + restspanning)
-
Duur van de blootstelling
Het risico op SSC neemt toe bij lagere temperaturen, waar materialen minder buigzaam zijn.
Materiaal is van belang
De norm NACE MR0175/ISO 15156 beschrijft geschikte materialen voor zure omgevingen bij olie- en gasproductie. Voor meer hulp bij het selecteren van componenten voor zure olievelden, zie Componenten voor vloeistofsystemen selecteren voor gebruik in zure olievelden.
Mogelijke oplossingen

Waterstofbrosheid
Waterstofatomen kunnen diffunderen in metalen, waardoor ze bros worden. Alle materialen die gevoelig zijn voor waterstofbrosheid zijn ook zeer gevoelig voor spanningscorrosiescheuren.
Hoe het ontstaat
Scheuren door waterstof kan optreden als het metaal wordt blootgesteld aan statische of cyclische trekspanning. Waterstof kan veranderingen veroorzaken in de mechanische eigenschappen en het gedrag van het metaal, waaronder:
- Vermindering van vervormbaarheid (rek en vermindering van oppervlakte)
- Vermindering van slagvastheid en breuktaaiheid
- Verhoogd vermoeiingsgedrag
Waterstofbrosheid kan worden voorkomen door materiaal te kiezen dat bestand is tegen waterstof, zoals austenitische legeringen met een nikkelgehalte tussen 10% en 30%.
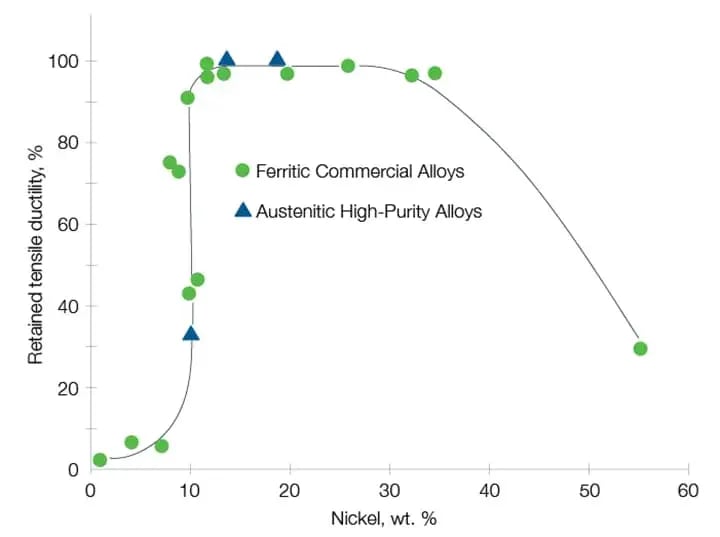
Bron: G.R. Caskey, Handboek waterstofcompatibiliteit voor roestvast staal (1983)
Mogelijke oplossingen

Interkristallijne corrosie
Om interkristallijne corrosie (IKC) te begrijpen, moet u bedenken dat alle metalen bestaan uit individuele korrels. Binnen elke korrel zijn de atomen systematisch gerangschikt, waardoor ze een driedimensionaal rooster vormen. IKC valt het materiaal aan langs de korrelgrenzen (waar de korrels waaruit het metaal bestaat samenkomen).
Hoe het ontstaat
Tijdens lassen, warmtebehandeling of blootstelling aan hoge temperaturen kunnen zich carbiden gaan vormen op de korrelgrenzen. Deze carbideprecipitaten kunnen na verloop van tijd groter worden. Deze carbidevorming beïnvloedt de uniforme verdeling van elementen binnen het metaal door materiaal naast de korrelgrenzen te beroven van belangrijke elementen, zoals chroom. Wanneer corrosieve vloeistoffen (zoals zuren) de chroomarme gebieden aanvallen, kunnen zich interkristalscheuren vormen. Deze scheuren kunnen zich door het hele materiaal verspreiden en onopgemerkt blijven, waardoor IKC een gevaarlijke vorm van corrosie is.

Mogelijke oplossingen

Galvanische corrosie in aanwezigheid van een elektrolyt
Galvanische corrosie treedt op wanneer materialen met een verschillend elektrodepotentiaal met elkaar in contact komen in de aanwezigheid van een elektrolyt.
De passieve laag op roestvast staal bestaat uit een zeer dunne chroomrijke oxidelaag die zich automatisch vormt in de omgevingslucht en het materiaal beschermt tegen corrosie. De passieve laag maakt een materiaal edeler en minder vatbaar voor corrosie. De compatibiliteit van metalen kan worden bepaald door de Anodische Index, die het potentiaal- of spanningsverschil beschrijft van metalen gemeten in zeewater ten opzichte van een standaard elektrode.
Hoe het ontstaat
Wanneer het potentiaalverschil tussen twee ongelijksoortige metalen in aanwezigheid van een elektrolyt te groot is, begint de passieve laag van het materiaal af te breken.
Mogelijke oplossingen
Om galvanische corrosie te vermijden, is het advies materialen te kiezen met een spanningsverschil dat niet groter is dan 0,2V. Bijvoorbeeld, een 316 roestvrijstalen fitting (-0,05V) met een 6-Moly tube(0,00V) zou resulteren in een spanning van 0,05V tussen de twee legeringen. Deze spanning is aanzienlijk lager dan 0,2 V, wat betekent dat het risico op galvanische corrosie laag is.

SCE staat voor Saturated Calomel Elektrode. Anodische index: Zeer edele materialen met "passieve oppervlakken" zijn niet zo gevoelig voor galvanische corrosie als minder edele materialen of als edele materialen met "actieve oppervlakken". In deze grafiek is magnesium het minst edele materiaal en grafiet het meest edele materiaal.
1 Picture: Reprinted from Science Direct, Volume 1, Issue 3, S.M.R. Ziaei, A.H. Kokabi, M. Nasr-Esehani, Sulfide Stress Corrosion Cracking and Hydrogen Induced Cracking of A216-WCC Wellhead Flow Control Valve Body case study, Pages 223-224, July 2013 with permission from Elsevier.
2 Picture: Hydrogen Embrittlement Image Courtesy of Salim Brahimi, IBECA Technologies Corp.
